Comment gérer la vaporisation dans un système d’analyse | Point de repère

Comment gérer la vaporisation dans un système d’analyse
12 mars 2019 | Jon Kestner
Il n’est ni facile, ni toujours possible de vaporiser un échantillon. Cependant, si l'analyseur de votre système d’échantillonnage requiert un gaz alors que votre échantillon est liquide, la seule possibilité consiste à transformer le liquide en gaz. Ce procédé est appelé vaporisation ou vaporisation instantanée. L'objectif est de faire passer instantanément l’échantillon d'un état entièrement liquide à un état gazeux sans en changer la composition.
Si vous procédez à une vaporisation, il est important de comprendre la différence entre évaporation et vaporisation. L'évaporation est un phénomène qui se produit progressivement lorsque la température augmente. La vaporisation se produit instantanément sous l’effet d’une chute de pression.
Il est impossible de vaporiser un échantillon en augmentant sa température. La chaleur entraîne une évaporation, et le fait d'augmenter la température ne fait qu'accélérer cette évaporation. Lorsque l’échantillon est un mélange, certains composants s'évaporent avant les autres, ce qui provoque un fractionnement du mélange. Dans le cas d'une vaporisation, lorsque celle-ci est réalisée correctement, tous les composants du mélange sont vaporisés en même temps, ce qui permet de conserver la composition de l'échantillon.
Les choses peuvent mal se passer lors d'une vaporisation. Au lieu de transformer instantanément l'ensemble de l'échantillon liquide en vapeur, vous pouvez involontairement provoquer une combinaison de vaporisation et d'évaporation, ce qui entraîne un fractionnement. Une fois les composants du mélange séparés, l'échantillon ne peut plus être utilisé pour une analyse.
En cas de fractionnement, les molécules les plus légères ont en général tendance à s'évaporer en premier et à se déplacer vers l'analyseur, tandis que les molécules les plus lourdes restent en arrière, dans la phase liquide. Même si, plus tard au cours du processus, un échantillon fractionné semble entièrement gazeux, les proportions des molécules du mélange ne seront plus ce qu'elles étaient avant le fractionnement. L'échantillon n'est donc plus représentatif du produit prélevé dans la ligne de process. Ajuster les variables de ce processus – température, pression et débit – contribue à garantir le bon déroulement de la vaporisation et l’exactitude des résultats de l’analyse.
Comprendre la vaporisation
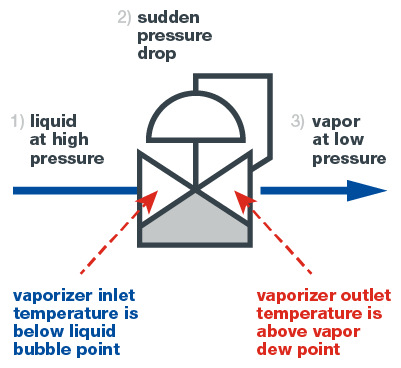
Pour vaporiser un échantillon, on utilise généralement un vapodétendeur, également appelé vaporiseur. Un vaporiseur est un détendeur qui a la capacité de transférer de la chaleur à l’échantillon au bon endroit dans le système. La vaporisation se déroule en trois étapes, comme le montre le schéma ci-dessous. Tout d’abord, l'échantillon pénètre dans le vapodétendeur à l'état liquide. À ce stade, le liquide ne doit pas bouillir.
Ensuite, le liquide traverse la cavité régulatrice du vapodétendeur, où il subit une chute de pression importante et soudaine qui entraîne sa vaporisation. Dans le même temps, l'échantillon est chauffé, ce qui permet au liquide vaporisé de rester à l'état gazeux.
Enfin, l'échantillon, désormais gazeux, sort du vapodétendeur et se déplace vers l'analyseur. Du fait du passage instantané à l'état gazeux, la composition du gaz est inchangée par rapport à celle du liquide, ce qui garantit l’exactitude des mesures.
De nombreuses variables déterminent le succès ou l'échec de ce processus délicat. Dans le cadre de cet exposé, nous considérerons deux ensembles principaux de variables.
Le premier ensemble de variables se rapporte à la composition de l'échantillon. En fonction de sa composition, l'échantillon va commencer à frémir et terminer sa vaporisation à des pressions et à des températures différentes. Pour gérer correctement le processus, il est nécessaire de connaître ces pressions et ces températures.
Le deuxième ensemble de variables concerne les paramètres du système d'échantillonnage que vous pouvez contrôler : pression, température et débit. La pression et la température sont contrôlées au niveau du vaporiseur, tandis que le débit est contrôlé en aval par un rotamètre (débitmètre à section variable) et une vanne à pointeau. Ces paramètres sont réglés en fonction de ce que nous savons du premier ensemble de variables. Une bonne vaporisation requiert un équilibre subtil de l'ensemble des variables. Même lorsque la vaporisation est abordée d'une manière aussi systématique, le processus s'accompagne d'une certaine dose d'essais et d'erreurs.
Connaître l’échantillon
Le meilleur moyen pour comprendre le premier ensemble de variables est de regarder un diagramme de phases. Un diagramme de phases représente la pression et la température, indiquant pour chaque couple (T,P) si une substance est à l'état gazeux, liquide ou solide. Les courbes délimitent les différentes phases.
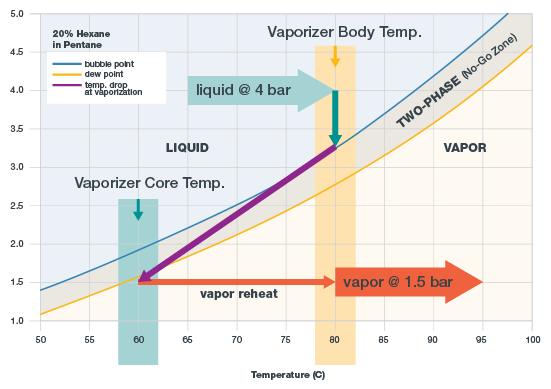
La figure ci-dessous montre le diagramme de phases d'un mélange d'hexane et de pentane contenant 20 % d'hexane. Lorsque l'échantillon se trouve au-dessus de la courbe de bulle (ligne bleue), il est entièrement liquide. L'échantillon doit être entièrement liquide lorsqu'il pénètre dans le vaporiseur. Lorsque le mélange se situe au-dessous de la courbe de rosée (ligne orange), il est entièrement gazeux. L'échantillon doit être entièrement gazeux lorsqu'il sort du vaporiseur.
Diagramme de phases d'un mélange contenant 80 % de pentane et 20 % d'hexane, avec les paramètres de température
Entre les courbes de bulle et de rosée se trouve la « zone interdite », c’est à dire la zone dans laquelle l’échantillon est en ébullition. Ici, deux phases cohabitent, le mélange étant partiellement à l'état liquide et partiellement à l'état gazeux. Si l'échantillon reste dans cette zone, il se fractionne et ne plus être utilisé pour une analyse.
Avec des échantillons purs ou presque purs, la plage d'ébullition est réduite, voire inexistante. Les courbes de bulle et de rosée sont quasiment superposées. Les échantillons liquides purs ou presque purs se transforment en un gaz ayant la même composition, que ce soit par évaporation ou par vaporisation. Certains échantillons industriels approchent ce niveau de pureté et se transforment facilement en vapeur.
En revanche, certains échantillons ont une plage d'ébullition tellement étendue qu'il est impossible de les vaporiser correctement. Il n'existe aucun moyen de passer de la phase liquide à la phase vapeur en évitant la plage d’ébullition. Il est impossible de modifier les variables – température, débit et pression – de manière à éviter le fractionnement.
La plupart des échantillons se situent entre ces deux extrêmes. Par exemple, dans le diagramme de phases de l’échantillon, la bande située entre les courbes de bulle et de rosée est suffisamment étroite pour que l'échantillon puisse, avec des réglages appropriés, passer efficacement du côté liquide au côté vapeur de la plage d’ébullition. La largeur de la bande impose toutefois de régler minutieusement ces variables pour éviter que l’échantillon ne se retrouve dans la plage d’ébullition.
Réglage de la température, de la pression et du débit
Le processus de vaporisation consiste à équilibrer les différentes variables. Le réglage des valeurs de température, de pression et de débit peut être effectué en suivant la procédure en quatre étapes décrite ci-dessous.
- Déterminer la pression à l'entrée du vaporiseur. Cette pression, qui est fixe, est celle du process, à condition que le vaporiseur soit situé près de la vanne de prélèvement. Une pression élevée est préférable, car elle permet de maintenir le vaporiseur à une température élevée sans pour autant provoquer l'ébullition du liquide entrant.
- Régler la température d'entrée. Il faut avoir deux objectifs en tête lors du réglage de la température. Tout d'abord, la température doit être assez basse pour que l'échantillon soit entièrement liquide et ne frémisse pas lorsqu'il pénètre dans le vaporiseur. Dans le diagramme de phases du mélange d’hexane et de pentane, la température d’ébullition à 4 bar est de 88°C. Pour se donner une marge d’erreur et maintenir l’échantillon à l’état liquide, on optera pour 80°C.
Ensuite, la température doit être assez élevée pour favoriser la vaporisation de l'échantillon. Lorsque vous vaporisez l'échantillon, sa température chute, conformément à la loi de conservation de l'énergie. La température de l'échantillon doit être assez élevée au début, pour que l'échantillon ne se retrouve pas dans la plage d'ébullition après la chute de pression. - Régler la pression à la sortie du vaporiseur. TL'objectif est d'abaisser la pression jusqu'à atteindre une valeur située en dessous de la courbe de rosée orange. Dans le diagramme de phases donné en exemple, la pression de sortie est réglée à 1,5 bar. Si, dans cet exemple, la pression de sortie était à peine supérieure, l'échantillon ne se vaporiserait pas entièrement et se fractionnerait.
- Régler le débit. Le débit est réglé en aval à l'aide d'une vanne et d'un rotamètre, et non pas au niveau du vaporiseur. Dans un système d'échantillonnage, il est souhaitable d'avoir un débit de vapeur élevé, car cela permet un déplacement plus rapide de l'échantillon vers l'analyseur. Toutefois, un débit élevé peut également être un problème, car la vaporisation de l'échantillon nécessite alors plus de chaleur. Autrement dit, un débit élevé entraîne une chute de température plus importante au moment de la vaporisation. Dans le diagramme de phases donné en exemple, la flèche violette représente la chute de température. Lorsque le débit augmente, la flèche violette s'incline davantage vers la gauche.
Une autre variable qui influence la chute de température est la capacité du vaporiseur à transférer la chaleur. Certains vaporiseurs sont fabriqués de manière à faciliter les transferts de chaleur à l'échantillon. Lorsque l'échantillon liquide se transforme en vapeur et que sa température chute, il tire de la chaleur de l'acier inoxydable qui l'entoure. La question essentielle est de savoir jusqu'à quel point le vaporiseur peut remplacer cette chaleur et continuer à la transférer à l'échantillon. Plus l'échantillon parvient à absorber de la chaleur, moins sa température chute pendant la vaporisation.
Dans certains cas, il est possible que le vaporiseur soit chaud au toucher à l'extérieur tout en étant froid à l'intérieur. Cela est dû au fait que l'échantillon vaporisé absorbe de grandes quantités de chaleur que le vaporiseur ne parvient plus à remplacer et à transférer. La meilleure solution consiste à diminuer le débit.
Le processus de vaporisation implique une certaine dose d’approximation. Les ingénieurs de terrain de Swagelok peuvent aider votre équipe à choisir des vaporiseurs adaptés à votre système d’échantillonnage. En règle générale, maintenez le débit à un niveau aussi faible que possible, en évitant toutefois de ralentir de manière excessive le cheminement de l'échantillon vers l'analyseur. Il est préférable de commencer avec un débit faible en essayant de l'augmenter, plutôt que de commencer d'emblée avec un débit élevé.
Résolution des problèmes
Les diagrammes de phases vous aideront à régler approximativement la température, la pression et le débit, mais il faudra certainement résoudre certains problèmes. Un signe certain de la présence d'un problème est la répétabilité médiocre des résultats fournis par l'analyseur. Deux possibilités sont présentées ci-dessous pour expliquer le fait que l'échantillon se fractionne au lieu de se vaporiser, le problème nº 1 étant le plus courant :
Problème nº 1: Seule une partie de l'échantillon est vaporisée. Le liquide traverse le vaporiseur et reste dans le tube en aval. Il finit par s’évaporer et absorbe la chaleur du tube environnant, ce qui rend le tube froid au toucher ou provoque la formation de givre ou de glace. Le liquide en aval du vaporiseur peut se déplacer au-delà de la zone du vapodétendeur, atteindre d'autres composants tels que des débitmètres ou des filtres, et causer des dégâts considérables.
Solution: TPour résoudre ce problème, la meilleure option est de diminuer le débit. Une autre possibilité consiste à diminuer la pression à la sortie du vaporiseur, si cela est possible. Une troisième solution consiste à fournir davantage de chaleur au vapodétendeur, sachant que cela risque de raccourcir la durée de vie de ce composant et de provoquer le problème nº 2 (voir ci-dessous).
Problème nº 2 : L'échantillon est en ébullition à l'entrée du vaporiseur. Il se fractionne avant d'être vaporisé. Signe de ce problème, le tube d'entrée du vaporiseur s'agite, parfois violemment, et les valeurs des mesures fluctuent. Les molécules les plus légères s'évaporent et produisent un important nuage de vapeur. Certaines de ces molécules se déplacent vers l'analyseur qui produit alors une mesure inexacte. Les molécules restantes créent un « mur de vapeur » qui renvoie le liquide dans le process. Ensuite, une partie de cette vapeur se refroidit et se condense. Enfin, l'échantillon liquide se déplace à nouveau vers le vaporiseur où les molécules les plus légères s'évaporent, et le cycle recommence. Les molécules les plus lourdes finissent par atteindre le vaporiseur et se déplacent vers l'analyseur qui produit une mesure totalement différente.
Solution: Pour résoudre ce problème, abaissez la température du vaporiseur.
Conclusion
La vaporisation d'un échantillon liquide est un processus difficile à réaliser. Partout dans le monde, les vaporiseurs de nombreux systèmes d'échantillonnage fractionnent constamment des échantillons et envoient sans cesse ces échantillons non représentatifs du process vers un analyseur. Vous pouvez considérablement augmenter les chances de réussir la vaporisation en utilisant le diagramme de phases correspondant au mélange propre à votre système. Vous augmenterez encore votre taux de réussite en acquérant une bonne connaissance des différentes étapes de la vaporisation, et en particulier des variables (température, pression et débit) et de leur influence sur l’issue du processus. Avec ce schéma bien en place, vous parviendrez à fixer correctement ces paramètres et il vous suffira d'effectuer quelques réglages en fonction des signes et des symptômes observés.
Articles Liés

Échangeurs de chaleur et systèmes de traçage vapeur : des pratiques éprouvées pour les ingénieurs d’études
Pour choisir les composants d’un échangeur de chaleur ou d’un système de traçage, il est nécessaire que les ingénieurs connaissent bien les caractéristiques et les conditions d’exploitation de leur réseau de vapeur. Découvrez les pratiques recommandées par Swagelok pour améliorer le réseau de vapeur de votre installation.

10 conseils pour améliorer les systèmes d’échantillonnage
Gérer le fonctionnement d’un système d'instrumentation analytique est un défi de taille. Obtenir des résultats cohérents et fiables peut s’avérer difficile même pour les ingénieurs et les techniciens les plus aguerris. Heureusement, quelques conseils simples permettront à votre équipe d’améliorer votre système d'échantillonnage.